孔稀释法是通过数荧光的方法测定慢病毒滴度 , 得到的结果为有感染能力的慢病毒颗粒数 。 下图是维真某慢病毒(3.20×108TU/mL)孔稀释法测滴度时的荧光图:
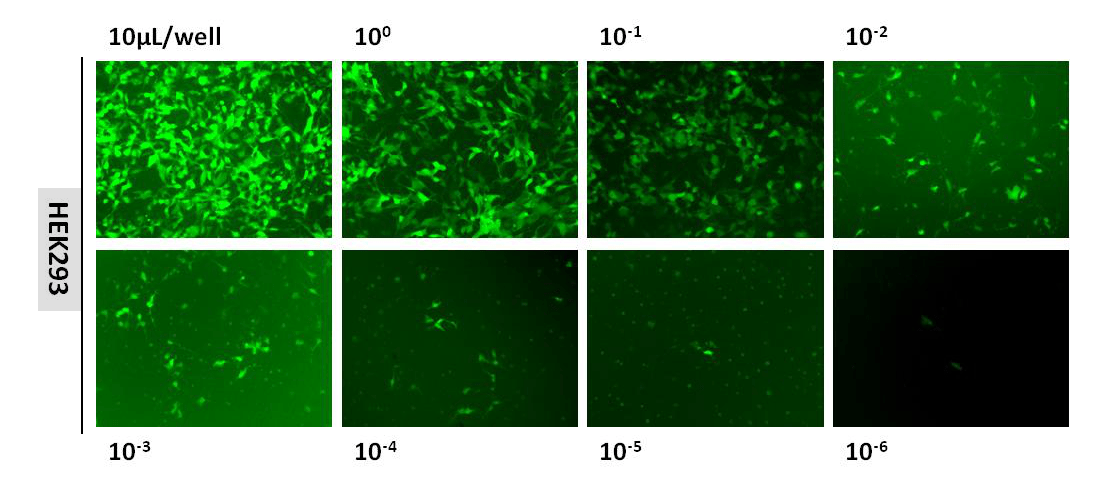
文章图片
维真生物采用2代慢病毒包装系统来制备慢病毒 。 该系统为三质粒系统 , 包括1个包装质粒(psPAX2)、1 个包膜质粒(pMD2G)、1个目的基因质粒和1株包装细胞(293T cell) 。 下图是慢病毒制备流程示意图: 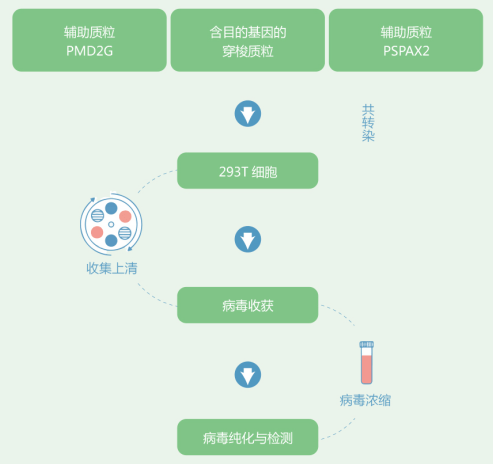
文章图片
1. 重组慢病毒的制备 Day1:汇合度90%的10cm dishs HEK293T细胞(~ 6×107/dish)按1:1比例传代至15cm dishs , 第二天细胞汇合度达到90%-95%(~ 1.5×108/dish) , 培养基为Gibico高糖DMEM培养基(含10%FBS) 。
Day2:1)转染前2-3个小时更换培养基(含10%FBS);
2)按照以下比例配制转染试剂:
Mix 1体积μlMix 2量DMEM(无FBS)1000μlDMEM(无FBS)1000μl目的基因质粒25μgVGF190μl(1μg/μl)PMD2G7.5μgPSPAX215μg
Mix 1和Mix 2分别混合后 , 室温5-10min, 后将Mix 1和Mix 2混合 , 室温30min , 加入至15cm dish中 。 (细胞达到汇合度90% , 细胞过少会影响转染效率)
Day3:6h-24h内更换新鲜培养基(含10%FBS) , 观察转染效率并拍照 。
Day5:72h观察细胞状态并拍照 。 收取上清培养基 , 过0.45μm滤膜 , 上清培养基加入超速离心管中 , 配平后离心 , 25000rpm , 4℃离心1.5h 。 弃上清 , 用适当病毒保存液回溶混匀溶解过夜 。
Day6:收集病毒分装 , 进行病毒滴度测定 。
2. 重组慢病毒滴度测定 2.1 整合数法标定不带荧光的重组慢病毒滴度
2.1.1 病毒感染细胞
①感染前6 h 在24孔细胞培养板中以2.5×105个细胞/孔 均匀接种HEK293细胞 。
②将慢病毒进行梯度稀释 , 共做3个梯度 , 即每孔(500μl 无双抗、无血清的DMEM培养基)中含10 μl、1 μl、0.1 μl 病毒 , 振荡混匀后加至接种好细胞的24孔板中 , 加病毒之前将培养板中的培养基吸净 。
③感染 18-20h 后 , 将培养板中的培养基更换为新鲜的DMEM完全培养基 。
④感染 64-68h 后收集细胞并进行基因组DNA的提取 。
⑤测定时 , 设置一组带荧光的已知TU的慢病毒作为对照 , 以校验检测出的数值 。
2.1.2 提取基因组DNA(按照AxyGEN 的基因组DNA提取试剂盒说明书进行操作)
2.1.3 qPCR检测
① 以被测慢病毒载体梯度稀释为标准品 , 慢病毒载体上的通用引物进行qPCR以获得病毒整合拷贝数 。
② 以Actin质粒梯度稀释为标准品 , Actin引物进行qPCR检测样品的基因组拷贝数以得到基因组拷贝数 。
③ qPCR
qPCR反应体系如下:
组成成分体积2 × SYBR Green mix10 μlPrimers (Forward & Reverse mixture)0.8 μl超纯水(DNase & RNase Free)7.2μl模板2μlTotal20μl
qPCR反应程序:
循环参数预变性95℃3min95℃5S60℃15S72℃15S+Plate Read39个循环
2.1.4 计算慢病毒IU(Integration Unit)ml-1
IU ml-1=(C×N×D×1000)/V
注:C=平均每基因组慢病毒整合拷贝数D=病毒的稀释倍数N=感染时细胞的数目(约为2.5×105)V=加入稀释病毒的体积数
2.2 孔稀释法标定带荧光的重组慢病毒滴度
Day1:细胞的准备
在96孔板中的每个孔中接种1-4×104个 HEK293细胞 。
Day2:病毒的稀释与感染
在Eppendorf管中做10倍梯度稀释 , 分别是1~10-6梯度 。 弃去96孔板中原有的培养基 , 将稀释好的病毒依次加入孔中 , 注意是两个重复 , 并做好标记 。
实验预览如图:
特别声明:本站内容均来自网友提供或互联网,仅供参考,请勿用于商业和其他非法用途。如果侵犯了您的权益请与我们联系,我们将在24小时内删除。
