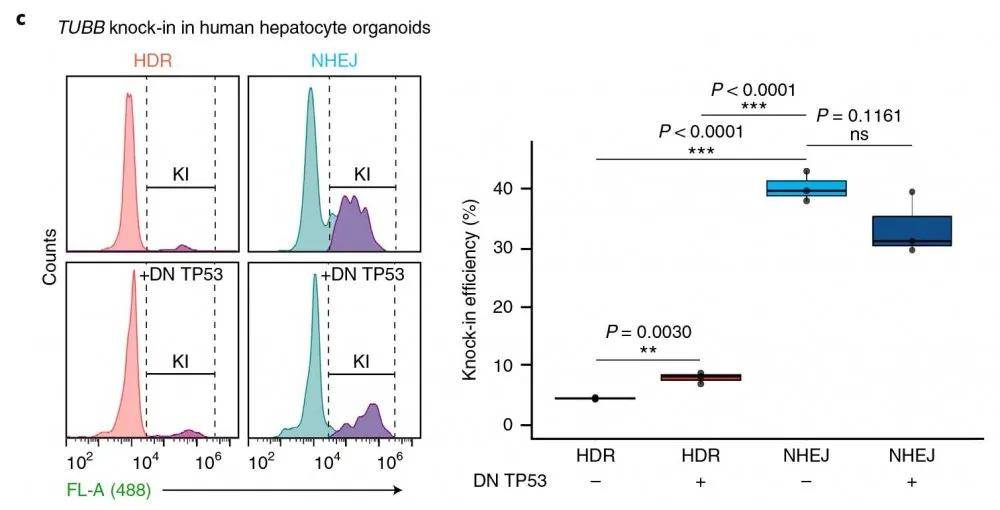
文章图片
流式细胞仪检测
补充数据图2如下:
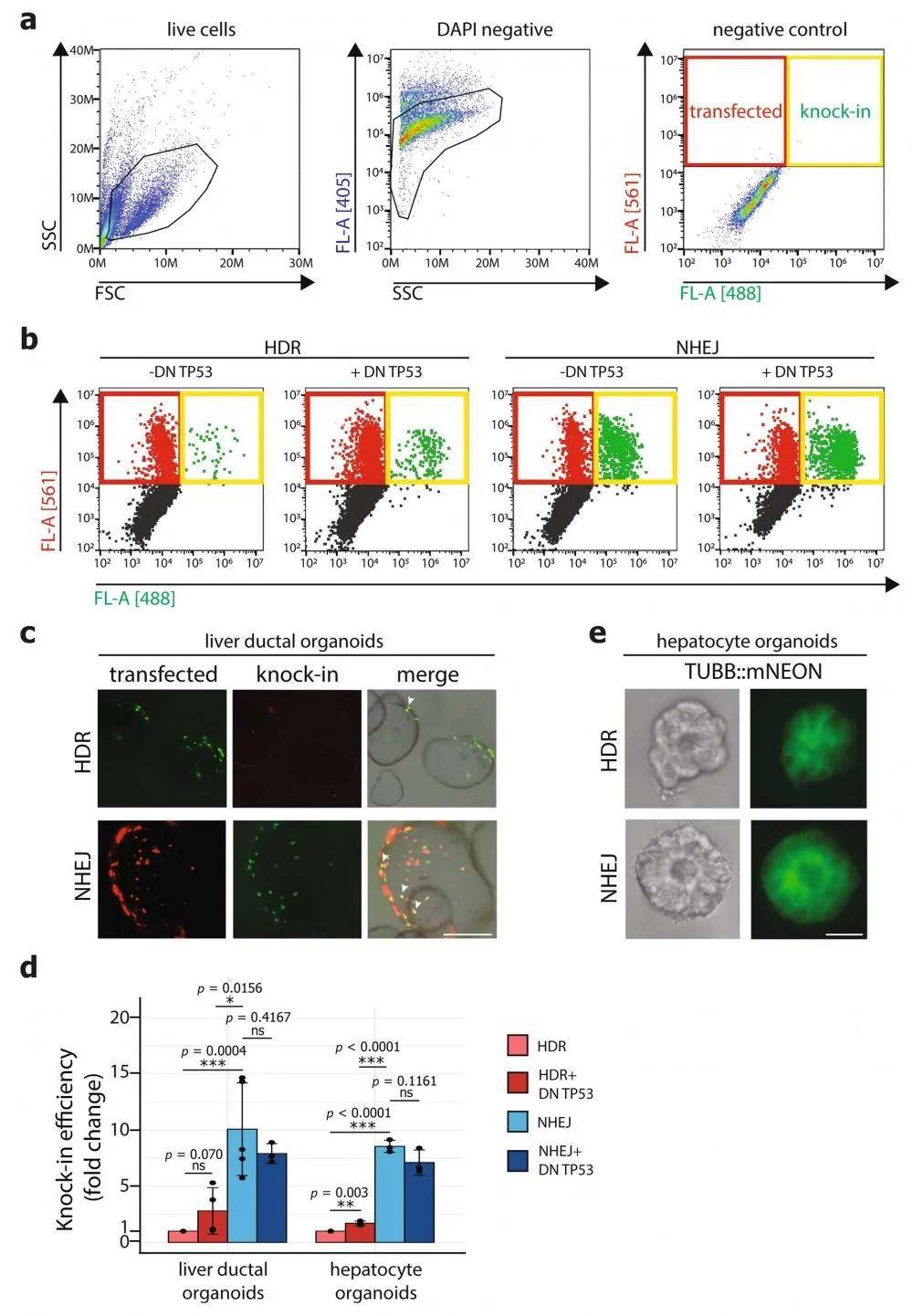
文章图片
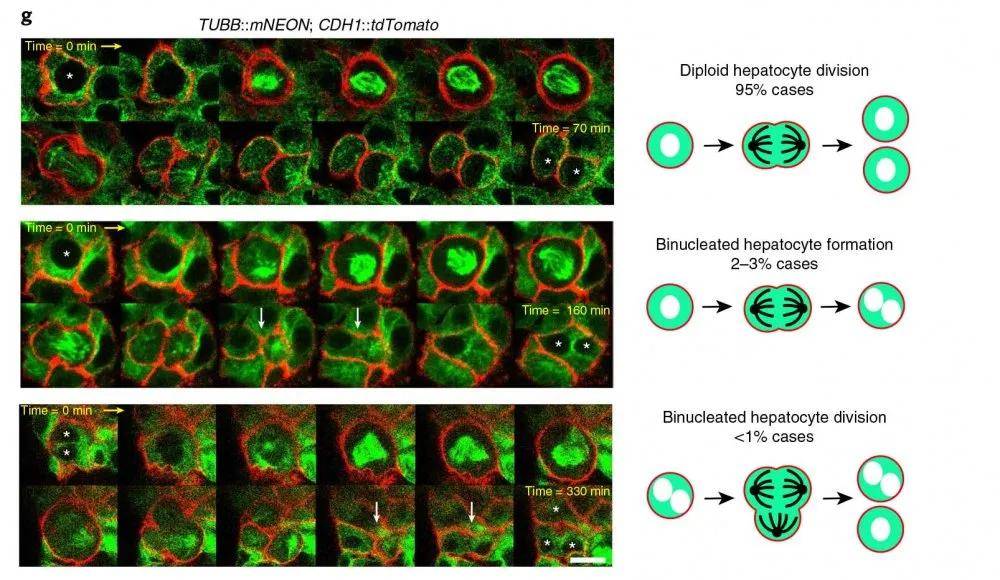
文章图片
图示 双报告基因肝细胞类器官中肝细胞分裂的不同方式
总的来说 , Hans Clevers研究组的工作用CRISPR-HOT方法 , 建立了不依赖于对TP53活性抑制的以NHEJ介导的基因编辑技术 , 简化了基因敲入的流程 , 对于肝细胞等成体干细胞来源的类器官可视化研究提供了可靠的基因编辑方式 。 虽然抑制TP53的活性之后 , HDR介导的基因敲入方式的效率略有提高 , 但仍然比NHEJ介导的基因编辑效率要低 , 研究人员相信CRISPR-HOT可以应用于许多类型的人体器官 , 可视化任何基因或细胞类型 , 对今后研究生物过程和疾病模型的建立有很大的帮助 。
在文章整个实验流程的重要步骤---转染流程当中 , 收获到了一把助力研究者们实验的“利器”——NEPA21 , NEPA GENE 。

文章图片
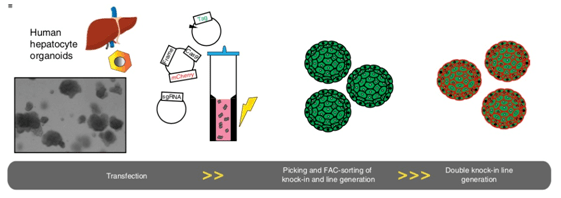
文章图片
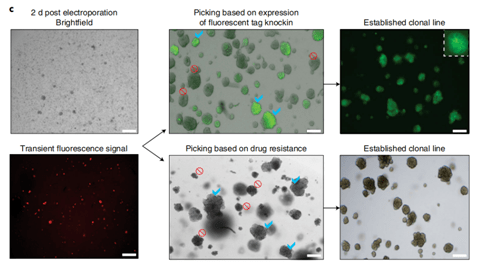
人类肝细胞的转染和敲入过程 。 类器官被分解成小的细胞团与质粒DNA混合 , 在电极杯中进行电穿孔 。 单个转染后的细胞生长为类细胞体 , 挑取建立克隆系 。
随后 , 在2020年11月 , Hansclever在Nature Protocols 杂志上发表的”Establishment of human fetal hepatocyteorganoids and CRISPR–Cas9-based geneknockin and knockout in organoid cultures fromhuman liver”,又使用了CRISPR HOT的方法对人类肝细胞来器官进行基因编辑 。
一直以来 , 人类原代肝脏细胞难以扩增培养 , 此文章中 , 作者详细列出了如何克服种种局限 , 建立了有助于人类胎儿肝细胞作为类器官的长期扩增的培养条件 。 此外 , 文章也介绍了如何在人类胎儿肝细胞和成人肝导管类器官系统中使用CRISPR–Cas9产生(多)基因敲除 。 使用CRISPR–Cas9和不依赖同源性的类器官转基因(CRISPR HOT)方法 , 可以在这些系统中实现有效的基因敲入 。 这些基因敲除可用于多种应用 , 例如疾病建模 , 研究基因功能和研究过程(例如细胞分化和细胞分裂) 。
文章图片
图示3:人类胎儿肝细胞类器官的基因组工程技术概略图
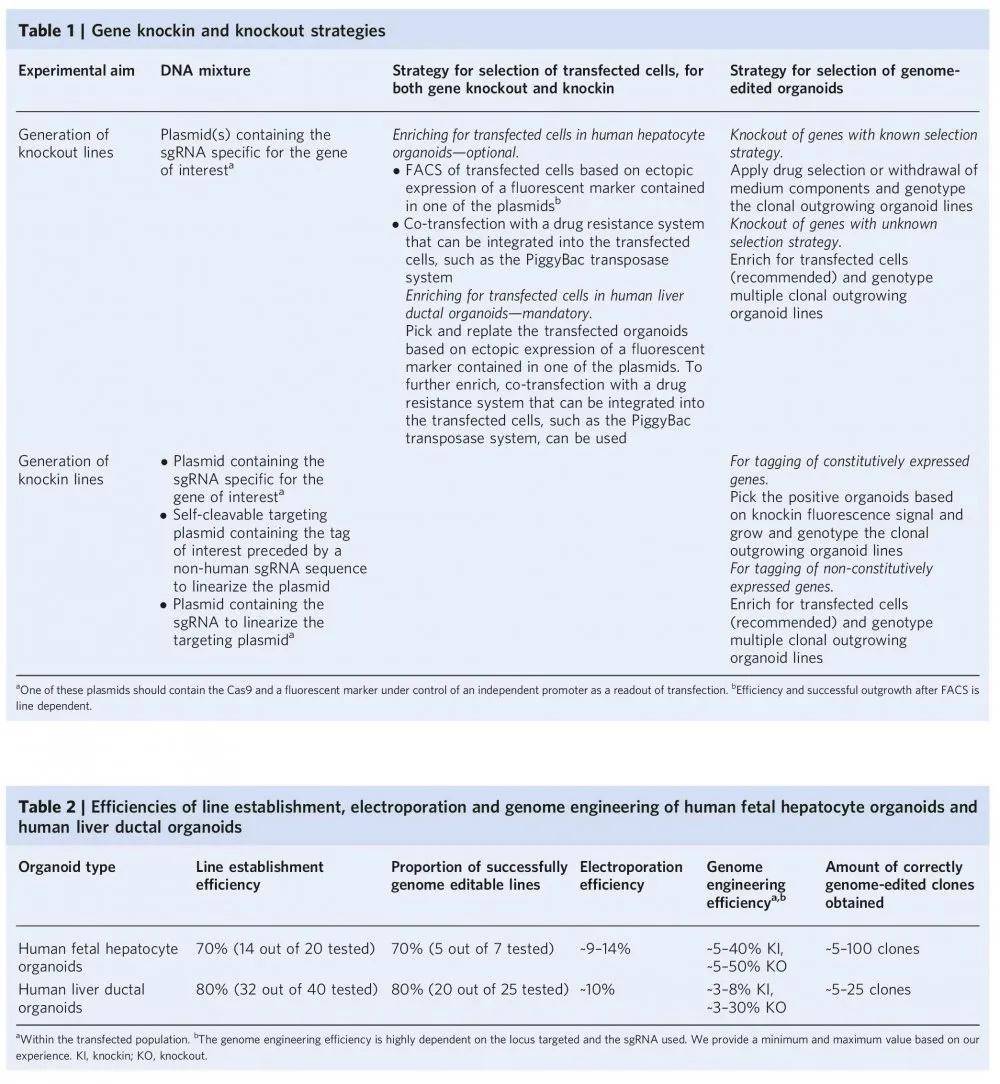
文章中 ,针对人类胎儿肝细胞和人类肝导管类器官的基因组编辑需要两种不同的实验程序(图3和4) 。 对于人类胎儿肝细胞类器官 , 采用基于比色皿电穿孔的转染策略。 为此 , 类器官必须分解成单细胞或小块细胞 , 建议从第5代及以后开始对肝细胞类器官系进行基因组工程设计 , 肝细胞类器官电穿孔的能力通常不会随时间而降低 , 作者已经成功地对人胎儿肝细胞类器官进行了基因组工程 , 可以做到至少第50代为止 ,相反 , 对于人肝导管类器官 , 转染步骤是对完整的类器官进行的 , 是一种离体组织电转染的方式。两种电转染方式均采用的NEPA21基因高效转染系统完成。 另外针对不同的编辑方式(Knock in和Knock out) , 作者也分享了非常详细的应对策略(见下图) 。 利用NEPA21在Hans Clever实验室所做的研究中也都得到了很高的编辑效率 。
文章图片
特别声明:本站内容均来自网友提供或互联网,仅供参考,请勿用于商业和其他非法用途。如果侵犯了您的权益请与我们联系,我们将在24小时内删除。
