【【推荐】Crisper/Cas9在类器官领域中的应用】介 绍
华粤企业集团旗下艾贝泰生物技术有限公司 细胞医学部 根据细胞存储、细胞治疗技术研发、应用研究等不同领域的特点 , 推出针对性应用技术的 细胞治疗平台 产品链 。
自 2009 年 , 荷兰科学家 Hans Clevers 实验室首次在体外将 Lgr5+ 肠道干细胞培养成小肠类器官 , 短短十几年 , 类器官(Organoid)火爆科研圈 , 成为炙手可热的体外模型系统 。
类器官是体外培育的 3D 迷你器官 , 能高度模拟体内组织器官的结构和功能 , 来源于组织或胚胎干细胞(ESCs)/诱导多能干细胞(iPSCs) 。 作为体外模型系统 , 类器官可用于解析遗传发育、建立疾病模型、筛选药物和检测毒性以及探索个性化医疗方案 。 目前 , 已成功培育出脑、结肠、内耳、小肠、肾脏、肝、肺、胰腺等不同器官的类器官 , 其培养条件及方法各不相同 。
CRISPR–HOT基因编辑方法的建立
CRISPR-Cas9等基因编辑工具在消除疾病和遗传疾病方面具有巨大的应用潜力 。 将突变基因替换为正常基因有可能成为未来医生治疗患者的重要手段 。 类器官是可以在实验室中生长的微型器官 。 目前 , 类器官在生命科学研究中应用广泛 , 其在发育生物学、病理学、细胞生物学、精准医疗以及药物毒性和药效试验等领域都有着巨大的应用潜力 。 通过改变不同类器官的基因可以极大地帮助研究生物学过程和疾病建模 。 然而 , 由于缺乏简单的基因组工程方法 , 基因组编辑人类类器官的构建比较困难 。
在2020年3份 , 荷兰Hubrecht Institute的Hans Clevers研究组在Nature Cell Biology杂志上发表文章Fast and efficient generation of knock-in human organoids using homology-independent CRISPR–Cas9 precision genome editing , 利用非同源依赖的CRISR-Cas9技术快速高效地对人源类器官进行基因敲入 , 作者们将该技术命名为CRISPR–HOT【CRISPR-Cas9-mediated homology-independent organoid transgenesis】 , 为人源类器官的内源基因敲入提供了重要的工具平台 。 该方法可标记人类类器官中的特定基因 , 简化了类器官的基因组编辑过程 , 为类器官可视化研究提供了可靠的基因编辑方式 。 研究人员利用这种新方法分析了肝细胞如何分裂以及DNA过多异常肝细胞是如何出现的 , 并发现敲除癌症基因TP53 , 异常肝细胞的非结构化分裂会更频繁 。 以上发现或有助于深入研究相关癌症的发展过程 。
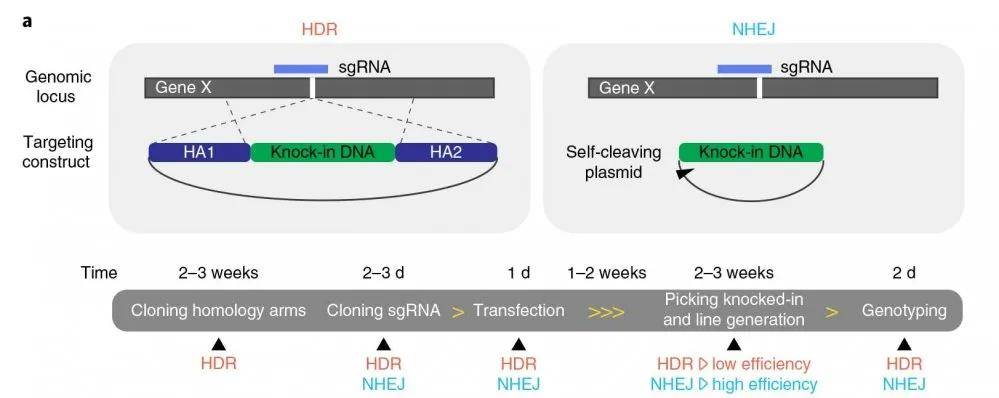
文章图片
图示1:HDR与NHEJ的技术路线以及优劣比较
研究者们为了印证CRISPR–HOT技术在人源类器官中进行基因敲入的方法可行 , 首先在两种难以转染的人源类器官(肝脏导管类器官及肝细胞类器官)进行测试 , 并对两种不同介导方式的基因敲入技术产生的类器官进行对比分析 。
结果显示:以KRT19基因为靶点 , 采用NEPA21 高效基因转染系统进行转染 ,转染5天后 , 观察了HDR条件下的一些敲入细胞 , 通过荧光激活细胞分选(FACS)分析了转染的敲入细胞(HDR和NHEJ 实验的转染效率均在0.2%~0.7%之间) 。 相比之下 , 研究者发现在检测NHEJ介导的基因插入时 , 敲入细胞明显增多(图1b , 补充数据图2a-c) 。
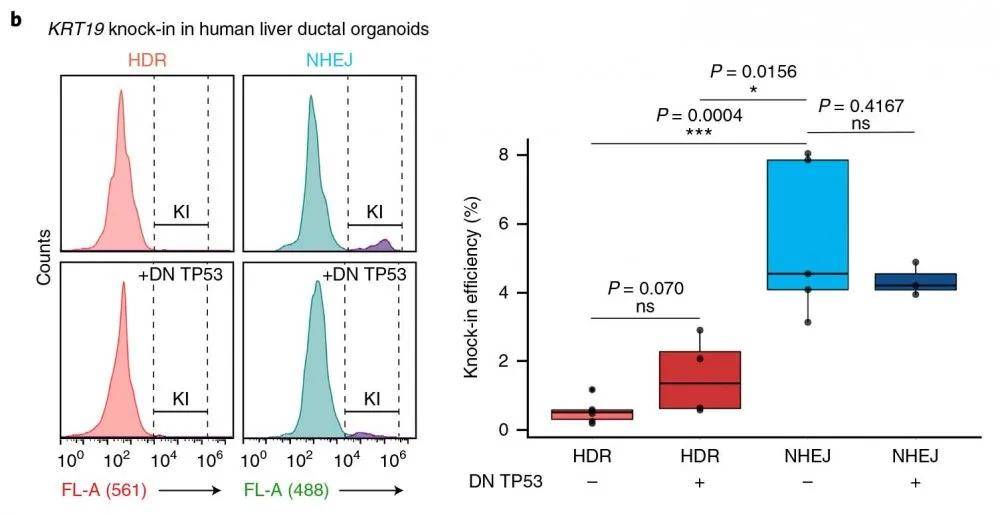
文章图片
图示流式细胞仪检测
以TUBB基因为靶点 , 采用NEPA21 基因高效转染系统进行细胞转染转染 , 再次观察到 , 与HDR介导的敲入相比 , 在转染的人群中 , NHEJ的效率显著提高(转染效率在9%~14%之间;图1c , 补充数据图2a , b)
特别声明:本站内容均来自网友提供或互联网,仅供参考,请勿用于商业和其他非法用途。如果侵犯了您的权益请与我们联系,我们将在24小时内删除。
