可见异物在不同药典中检查要求异同及检测分析方法
文章图片
USP是美联邦对药品质量标准和验证方法的技术规定 , 是企业、单位、机构生产、使用、管理、检验药品、化学品、化工品的法律依据 。 2016年USP药典首次增加了附录注射剂的可见异物 , 明确列出了可见异物的检查方法和放行标准及其在售产品可见异物的检查要求 。
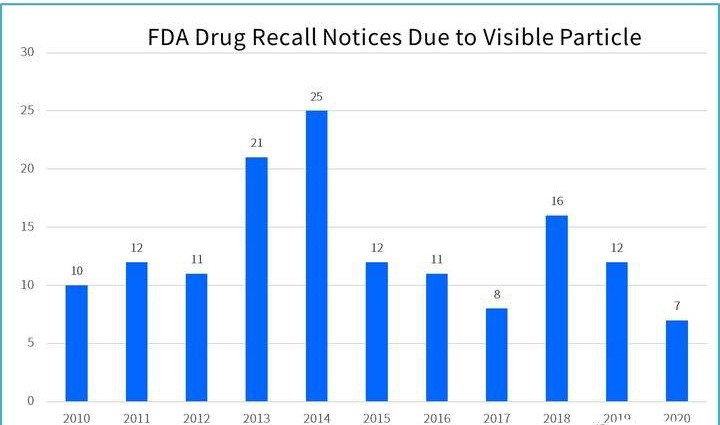
FDA官网公布的每年因可见异物产生的药品召回事件(图片来源网络)放行标准在黑色背景和白色背景下检查 , 照明强度至少保持在2000到3750勒克斯之间 。 检查时应当轻轻地旋转或倒置 , 确保无气泡产生 , 并在每个背景下检查大约5秒 。 抽样和检查采用ANSI/ASQZ1.4标准 。 通常检查水平Ⅱ , 正常检查的单次抽样计划的AQL为0.65%;在售产品检查在黑色背景和白色背景下检查 , 照明强度至少保持在2000到3750勒克斯之间 。 检查时应当轻轻地旋转和/或倒置 , 确保无气泡产生 , 并在每个背景下检查大约5秒 。
USP药典要求检出可见异物的支数不超标准规定 , 而我国药典要求每支产品检出的可见异物的数量不超标准规定 。 我国将药物中因生产工艺不完善或因异常事件导致药物中出现的可见物杂质定义为可见异物 , 并详述了相关的检测方法和对可见异物数量的规定 。 详细为可见异物系指出现于注射剂 , 眼用液体机制和无菌原料药中 , 在规定条件下目视可以观测到的不溶性物质 , 其粒径或长度通常大于50μm 。
利用红外光谱、核磁共振、GC-MS、ICP、IC、HPLC、XRF、GPC、SEM、D-SIMS等仪器 , 微源检测可结合基础化学常用手段及相关特性验证 , 多方面验证分析结果 , 对可见异物可进行相关的检测分析 。 包括注射剂或其它液体、冻干粉或其它粉末、西林瓶、塑料瓶等容器、医疗设备和医疗用具、其它包装材料等 。
【可见异物在不同药典中检查要求异同及检测分析方法】药物中的可见异物颗粒的出现轻则影响到药液质量 , 影响到产品的申报和上市 , 重则影响到药品的有效和安全性 。 随着生物制药的飞速发展 , 可见异物颗粒的问题也愈发受到各个国家监管机构和药企的特别关注 。 更多可见异物问题欢迎评论区留言!
- 在装修之前都弄清楚了吗?起居室电视墙这几个误区你知道吗?
- 如何在家中安装垃圾处理装置 - 逐步完成初学者指南
- 你仍在把银狐犬叫成萨摩耶吗?
- 香港目前可以去吗 导游证可以直接去香港吗现在
- 小泰迪和vip一样吗?区别在哪儿?
- 图解风靡日本的美体修身法?
- 淘宝降权记录查不到咋回事?怎么解决?
- 京东双十一plus会员价格是多少
- 京东双十一是什么时候开始
- 没本钱怎么在手机一天赚500 100元投资赚100元它的利润是多少
特别声明:本站内容均来自网友提供或互联网,仅供参考,请勿用于商业和其他非法用途。如果侵犯了您的权益请与我们联系,我们将在24小时内删除。
